Standar Kompetensi:
2. Memahami klasifikasi zat
Kompetensi Dasar:
2.1 Mengelompokkan sifat larutan asam, larutan basa, dan larutan garam melalui alat dan indikator yang tepat
2.2 Melakukan percobaan sederhana dengan bahan-bahan yang diperoleh dalam kehidupan sehari-hari
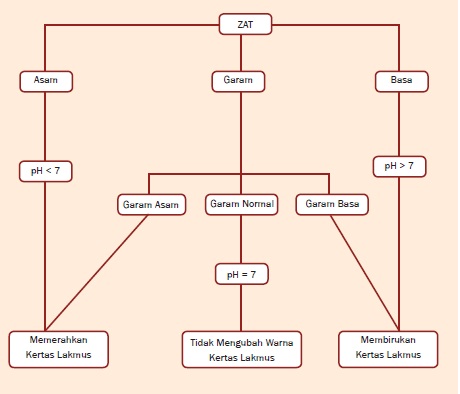
Peta Konsep
A. Sifat-Sifat Asam, Basa, dan Garam
Istilah asam (acid) berasal dari bahasa
Latin acetum yang berarti cuka. Seperti diketahui, zat utama dalam cuka
adalah asam asetat. Basa (alkali) berasal dari bahasa Arab yang berarti
abu.
Seperti halnya dengan sabun, basa
bersifat kaustik (licin), selain itu basa juga bersifat alkali (bereaksi
dengan protein di dalam kulit sehingga sel-sel kulit akan mengalami
pergantian). Rasa pahit merupakan salah satu sifat zat yang bersifat
basa.
Kita dapat mengenali asam dan basa dari
rasanya. Namun, kita dilarang mengenali asam dan basa dengan cara
mencicipi karena cara tersebut bukan merupakan cara yang aman. Untuk
mengidentifikasi asam dan basa yang baik dan aman dapat dengan
menggunakan indikator. Indikator yaitu suatu bahan yang dapat bereaksi
dengan asam, basa, atau garam sehingga akan menimbulkan perubahan warna.
1. Asam
Asam merupakan salah satu penyusun dari
berbagai bahan makanan dan minuman, misalnya cuka, keju, dan
buah-buahan. Menurut Arrhenius, asam adalah zat yang dalam air akan
melepaskan ion H+. Jadi, pembawa sifat asam adalah ion H+ (ion
hidrogen), sehingga rumus kimia asam selalu mengandung atom hidrogen.
Ion adalah atom atau sekelompok atom yang bermuatan listrik. Kation
adalah ion yang bermuatan listrik positif. Adapun anion adalah ion yang
bermuatan listrik negatif.
Sifat khas lain dari asam adalah dapat
bereaksi dengan berbagai bahan seperti logam, marmer, dan keramik.
Reaksi antara asam dengan logam bersifat korosif. Contohnya, logam besi
dapat bereaksi cepat dengan asam klorida (HCl) membentuk Besi
(II) klorida (FeCl2).
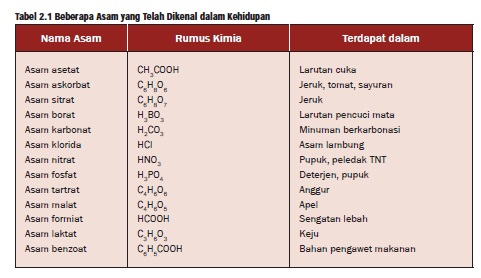
Tabel beberapa contoh asam
Berdasarkan asalnya, asam dikelompokkan dalam 2 golongan, yaitu asam organik dan asam anorganik. Asam organik umumnya bersifat asam lemah, korosif, dan banyak terdapat di alam. Asam anorganik
umumnya bersifat asam kuat dan korosif. Karena sifat-sifatnya itulah,
maka asam-asam anorganik banyak digunakan di berbagai kebutuhan manusia.
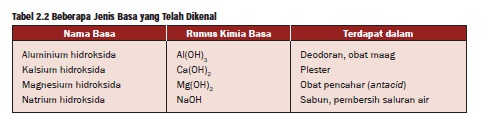
2.Basa
Dalam keadaan murni, basa umumnya berupa
kristal padat dan bersifat kaustik. Beberapa produk rumah tangga seperti
deodoran, obat maag (antacid) dan sabun serta deterjen mengandung basa.
Basa adalah suatu senyawa yang jika
dilarutkan dalam air (larutan) dapat melepaskan ion hidroksida (OH-).
Oleh karena itu, semua rumus kimia basa umumnya mengandung gugus OH.
Jika diketahui rumus kimia suatu basa,
maka untuk memberi nama basa, cukup dengan menyebut nama logam dan
diikuti kata hidroksida.
Tabel beberapa contoh Basa
Perbedaan Sifat Asam dan Basa
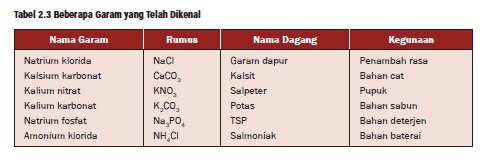
3. Garam
Orang mengalami sakit perut disebabkan
asam lambung yang meningkat. Untuk menetralkan asam lambung (HCl)
digunakan antacid. Antacid mengandung basa yang dapat menetralkan
kelebihan asam lambung (HCl).
Umumnya zat-zat dengan sifat yang
berlawanan, seperti asam dan basa cenderung bereaksi membentuk zat baru.
Bila larutan asam direaksikan dengan larutan basa, maka ion H+ dari
asam akan bereaksi dengan ion OH- dari basa membentuk molekul air.
H+ (aq) + OH- (aq) —> H2O (ℓ)
Asam Basa Air
Karena air bersifat netral, maka reaksi asam dengan basa disebut reaksi penetralan.
Ion-ion ini akan bergabung membentuk
senyawa ion yang disebut garam. Bila garam yang terbentuk ini mudah
larut dalam air, maka ion-ionnya akan tetap ada di dalam larutan. Tetapi
jika garam itu sukar larut dalam air, maka ion-ionnya akan bergabung
membentuk suatu endapan. Jadi, reaksi asam dengan basa disebut juga
reaksi penggaraman karena membentuk senyawa garam.
Mari kita simak contoh reaksi pembentukan garam berikut!
Mari kita simak contoh reaksi pembentukan garam berikut!
Asam + Basa —> Garam + Air
Asam klorida + Natrium hidroksida —> Natrium klorida + air
HCl (aq) + Na OH (aq) —> Na Cl (aq) + H2O (ℓ)
Asam Basa Garam Air
Walaupun reaksi asam dengan basa disebut
reaksi penetralan, tetapi hasil reaksi (garam) tidak selalu bersifat
netral. Sifat asam basa dari larutan garam bergantung pada kekuatan asam
dan basa penyusunnya.
Garam yang berasal dari asam kuat dan
basa kuat bersifat netral, disebut garam normal, contohnya NaCl dan
KNO3. Garam yang berasal dari asam kuat dan basa lemah bersifat asam dan
disebut garam asam, contohnya adalah NH4 Cl. Garam yang berasal dari
asam lemah dan basa kuat bersifat basa dan disebut garam basa, contohnya
adalah CH3COONa.
Contoh asam kuat adalah HCl, HNO3, H2SO4. Adapun KOH, NaOH,
Ca(OH)2 termasuk basa kuat.
Contoh asam kuat adalah HCl, HNO3, H2SO4. Adapun KOH, NaOH,
Ca(OH)2 termasuk basa kuat.
Tabel beberapa contoh garam
4. Larutan Asam, Basa, dan Garam Bersifat Elektrolit
Ketika seseorang mencari ikan dengan
menggunakan ”setrum” atau aliran listrik yang berasal dari aki, apa
yang terjadi setelah beberapa saat ujung alat yang telah dialiri arus
listrik itu dicelupkan ke dalam air sungai? Ternyata ikan yang berada di
sekitar ujung alat itu terkena aliran listrik dan pingsan atau mati.
Apakah air dapat menghantarkan listrik?
Sebenarnya air murni adalah penghantar
listrik yang buruk. Akan tetapi bila dilarutkan asam, basa, atau garam
ke dalam air maka larutan ini dapat menghantarkan arus listrik. Zat-zat
yang larut dalam air dan dapat membentuk suatu larutan yang
menghantarkan arus listrik dinamakan larutan elektrolit. Contohnya
adalah larutan garam dapur dan larutan asam klorida. Zat yang tidak
menghantarkan arus listrik dinamakan larutan nonelektrolit. Contohnya
adalah larutan gula dan larutan urea.
Untuk mengetahui suatu larutan dapat
menghantarkan arus listrik atau tidak, dapat diuji dengan alat penguji
elektrolit. Alat penguji elektrolit sederhana terdiri dari dua elektroda
yang dihubungkan dengan sumber arus listrik searah dan dilengkapi
dengan lampu, serta bejana yang berisi larutan yang akan diuji. Mari
kita lakukan kegiatan berikut untuk mengetahui apakah asam, basa, dan
garam dapat menghantarkan arus listrik.
B. Identifikasi Asam, Basa, dan Garam
Banyak sekali larutan di sekitar kita,
baik yang bersifat asam, basa, maupun netral. Cara menentukan sifat asam
dan basa larutan secara tepat yaitu menggunakan indikator. Indikator
yang dapat digunakan adalah indikator asam basa. Indikator adalah
zat-zat yang menunjukkan indikasi berbeda dalam larutan asam, basa, dan
garam. Cara menentukan senyawa bersifat asam, basa, atau netral dapat
menggunakan kertas lakmus dan larutan indikator atau indikator alami.
Berikut adalah beberapa cara menguji sifat larutan.
1. Identifikasi dengan Kertas Lakmus
Warna kertas lakmus dalam larutan asam,
larutan basa dan larutan bersifat netral berbeda. Ada dua macam kertas
lakmus, yaitu lakmus merah dan lakmus biru. Sifat dari masing-masing
kertas lakmus tersebut adalah sebagai berikut.
a. Lakmus merah dalam larutan asam berwarna merah dan dalam larutan basa berwarna biru.
b. Lakmus biru dalam larutan asam berwarna merah dan dalam larutan basa berwarna biru.
c. Lakmus merah maupun biru dalam larutan netral tidak berubah warna.
b. Lakmus biru dalam larutan asam berwarna merah dan dalam larutan basa berwarna biru.
c. Lakmus merah maupun biru dalam larutan netral tidak berubah warna.
2. Identifikasi Larutan Asam dan Basa Menggunakan Indikator Alami
Cara lain untuk mengidentifikasi sifat
asam atau basa suatu zat dapat menggunakan indikator alami. Berbagai
bunga yang berwarna atau tumbuhan, seperti daun, mahkota bunga, kunyit,
kulit manggis, dan kubis ungu dapat digunakan sebagai indikator asam
basa. Ekstrak atau sari dari bahan-bahan ini dapat menunjukkan warna
yang berbeda dalam larutan asam basa.
Sebagai contoh, ambillah kulit manggis,
tumbuklah sampai halus dan campur dengan sedikit air. Warna kulit
manggis adalah ungu (dalam keadaan netral). Jika ekstrak kulit manggis
dibagi dua dan masing-masing diteteskan larutan asam dan basa, maka
dalam larutan asam terjadi perubahan warna dari ungu menjadi
cokelat kemerahan. Larutan basa yang diteteskan akan mengubah warna dari
ungu menjadi biru kehitaman.
C. Penentuan Skala Keasaman dan Kebasaan
1. Kekuatan Asam dan Basa
Kekuatan suatu asam atau basa tergantung
bagaimana senyawa tersebut dapat diuraikan menjadi ion-ion dalam air.
Peristiwa terurainya suatu zat menjadi ion-ionnya dalam air disebut
ionisasi. Asam atau basa yang terionisasi secara sempurna dalam
larutan merupakan asam kuat atau basa kuat. Sebaliknya asam atau
basa yang hanya terionisasi sebagian merupakan asam lemah atau
basa lemah.
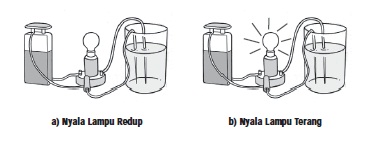
Jika ingin mengetahui kekuatan asam dan
basa maka dapat dilakukan percobaan sederhana. Perhatikan nyala lampu
saat mengadakan percobaan uji larutan elektrolit. Bila nyala lampu
redup berarti larutan tergolong asam atau basa lemah, sebaliknya
apabila nyala lampu terang berarti larutan tersebut tergolong asam
atau basa kuat.
Asam kuat atau asam lemah pada
konsentrasi yang sama menghantarkan listrik yang berbeda. Nyala lampu
pada Gambar (a) tampak redup. Ini berarti larutan yang diuji berupa asam
lemah atau basa lemah. Adapun pada Gambar (b) lampu menyala terang,
menandakan bahwa larutan yang diuji berupa asam kuat atau basa kuat.
2. Derajat Keasaman dan Kebasaan (pH dan pOH)
Pada dasarnya derajat/tingkat keasaman
suatu larutan (pH = potenz Hydrogen)) bergantung pada konsentrasi ion H+
dalam larutan. Semakin besar konsentrasi ion H+ semakin asam larutan
tersebut.
Umumnya konsentrasi ion H+ pada larutan
sangat kecil, maka untuk menyederhanakan penulisan digunakan konsep pH
untuk menyatakan konsentrasi ion H+. Nilai pH sama dengan
negatif logaritma konsentrasi ion H+ dan secara matematika
dinyatakan dengan persamaan
pH = – log (H+)
Analog dengan pH, konsentrasi ion OH–
juga dapat dinyatakan dengan cara yang sama, yaitu pOH (Potenz
Hydroxide) dinyatakan dengan persamaan berikut.
pOH = – log (OH-)
Derajat keasaman suatu zat (pH) ditunjukkan dengan skala 0—14.
a. Larutan dengan pH < 7 bersifat asam.
b. Larutan dengan pH = 7 bersifat netral.
c. Larutan dengan pH > 7 bersifat basa.
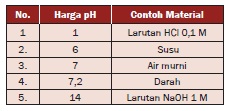
Jumlah harga pH dan pOH = 14. Misalnya,
suatu larutan memiliki pOH = 5, maka harga pH = 14 – 5 = 9. Harga pH
untuk beberapa jenis zat yang dapat kita temukan di lingkungan
sehari-hari dinyatakan dalam Tabel.
Tabel Harga pH untuk Beberapa Jenis Zat
3. Menentukan pH Suatu Larutan
Derajat keasaman (pH) suatu larutan dapat
ditentukan menggunakan indikator universal, indikator stick, larutan
indiaktor, dan pH meter.
a. Indikator Universal.
Indikator universal merupakan campuran
dari bermacam-macam indikator yang dapat menunjukkan pH suatu
larutan dari perubahan warnanya. Indikator universal ada dua macam yaitu
indikator yang berupa kertas dan larutan.
b. Indikator Kertas (Indikator Stick)
Indikator kertas berupa kertas serap dan
tiap kotak kemasan indikator jenis ini dilengkapi dengan peta warna.
Penggunaannya sangat sederhana, sehelai indikator dicelupkan ke
dalam larutan yang akan diukur pH-nya. Kemudian dibandingkan dengan peta
warna yang tersedia.
c. Larutan Indikator
Salah satu contoh indikator universal
jenis larutan adalah larutan metil jingga (Metil Orange = MO). Pada pH
kurang dari 6 larutan ini berwarna jingga, sedangkan pada pH lebih dari 7
warnanya menjadi kuning.
Contoh indikator cair lainnya adalah
indikator fenolftalin (Phenolphtalein = pp). pH di bawah 8, fenolftalin
tidak berwarna, dan akan berwarna merah anggur apabila pH larutan di
atas 10.
d. pH Meter
Pengujian sifat larutan asam basa dapat
juga menggunakan pH meter. Penggunaan alat ini dengan cara dicelupkan
pada larutan yang akan diuji, pada pH meter akan muncul angka skala
yang menunjukkan pH larutan.









Tidak ada komentar:
Posting Komentar